Metale conductoare. Conductivitate electrică
Lungime și distanță Masă Măsuri ale volumului de solide și alimente în vrac Aria Volumul și unitățile de măsură în retete culinare Temperatura Presiune, stres mecanic, modulul Young Energie și lucru Putere Forță Timp Viteză liniară Unghi plan Eficiența termică și eficiența combustibilului Numere Unități de măsurare a cantității de informații Rate de schimb Mărimile îmbrăcăminte și încălțăminte pentru femei Mărimile îmbrăcăminte și încălțăminte pentru bărbați Viteza unghiulară și viteza de rotație Accelerație Accelerație unghiulară Densitate Volum specific Moment de inerție Moment de forță Cuplu Căldura specifică de ardere (în masă) Densitatea energiei și căldura specifică de ardere a combustibilului (în volum) Diferența de temperatură Coeficient de dilatare termică Rezistență termică Conductivitate termică Căldura specifică Expunerea la energie, puterea radiației termice Densitatea fluxului de căldură Coeficientul de transfer de căldură Debitul de volum Debitul de masă Debitul de masă Densitatea de flux de masă Concentrația molară Concentrația de masă în soluție Vâscozitate dinamică (absolută) Vâscozitate cinematică Tensiune superficială Permeabilitatea la vapori Permeabilitatea la vapori, rata de transfer de vapori Nivel de sunet Sensibilitate microfon Presiunea sonoră (SPL) ) Luminozitate Intensitate luminoasă Iluminare Rezoluție grafică pe computer Frecvență și lungime de undă Putere optică în dioptrii și distanță focală Putere optică în dioptrii și mărire a lentilei (×) Sarcină electrică Densitate de încărcare liniară Densitate de încărcare de suprafață Densitate de încărcare volumetrică Curent electric Densitate de curent liniar Curent de suprafață densitate Câmp electric de tensiune Potențial și tensiune electrostatică Rezistență electrică Specific rezistenta electrica Conductivitate electrică Conductivitate electrică Capacitate electrică Inductanță Ecartament american de sârmă Niveluri în dBm (dBm sau dBmW), dBV (dBV), wați și alte unități Forța magnetomotoare Tensiune câmp magnetic Flux magnetic Inducție magnetică Viteza de doză absorbită a radiațiilor ionizante Radioactivitate. Dezintegrare radioactivă Radiație. Doza de expunere Radiații. Doza absorbită Prefixe zecimale Comunicarea datelor Tipografie și procesare imagini Unități de volum de lemn Calcul masa molara Tabel periodic elemente chimice D. I. Mendeleev
Câmpurile electrice sunt detectate folosind un sistem de organe sensibile la electricitate din piele. Fiecare flacon conține un tub umplut cu o substanță gelatinoasă care este în contact cu mediu extern prin porii pielii animalelor. Capătul interior al tubului se termină în subsol, unde sunt amplasate celulele care transportă semnale electrice către sistemul nervos peşte. Până acum, oamenii de știință nu au putut explica modul în care un semnal electric slab trece printr-o țeavă din exterior în subsol.
Cu toate acestea, acum, fizicienii și biofizicienii de la Universitatea din California, Santa Cruz, împreună cu alți colegi, au ajuns la concluzia că jeleul este un conductor de protoni excepțional de bun, ceea ce explică și transmiterea semnalelor electrice. Echipa a încercat să testeze mostre de rechin și ridichi. Oamenii de știință de la Rosol au plasat între doi electrozi de paladiu capabili să absoarbă și să emită număr mare protoni. Tensiunea aplicată electrozilor face ca protonii din electrodul pozitiv să intre în jeleu și să se deplaseze către electrodul negativ.
Valoarea inițială
Valoare convertită
siemens per metru picosiemens per metru mo pe metru mo pe centimetru abmo per metru abmo per centimetru statmo per metru statmo per centimetru siemens per centimetru milisiemens pe metru milisiemens per centimetru microsiemens per metru microsiemens per centimetru unitate convențională de conductivitate electrică coeficient convențional de conductivitate electrică ppm , coeficient. recalculare 700 ppm, coeficient. recalculare 500 ppm, coeficient. recalculare 640 TDS, ppm, coeficient. recalculare 640 TDS, ppm, coeficient. recalculare 550 TDS, ppm, coeficient. recalculare 500 TDS, ppm, coeficient. recalculare 700
Curentul de protoni este ușor de măsurat, deoarece este același cu curentul electric care curge printr-o tensiune aplicată. Deși măsurătorile au arătat că jeleul este un bun conductor de protoni, nu oferă valoarea exacta conductivitate. Protonii trebuie să învingă rezistența de contact pe măsură ce intră și ies din electrozii de paladiu, iar măsurătorile de conductivitate îi afectează. Acest lucru a fost ocolit de faptul că măsurarea a fost efectuată și pe doi electrozi de aur plasați în jeleu între electrozii de paladiu.
Măsurarea tensiunii dintre electrozii de aur și curentul dintre electrozii de paladiu ne-a permis să calculăm valoarea exactă a conductivității. Oamenii de știință sunt convinși că conductivitatea ridicată a protonilor a acestui material biologic se datorează prezenței unei molecule în lanț numită keratan sulfat. Este un acid, ceea ce înseamnă că fiecare moleculă de sulfat de cheratină poate furniza un proton pentru a crește conductivitatea. Acești protoni pot călători apoi de-a lungul lanțurilor de molecule de apă care se formează în jurul sulfatului de keratan.
Mai multe despre conductivitatea electrică
Introducere și definiții
Conductivitate electrică (sau conductivitate electrică) este o măsură a capacității unei substanțe de a conduce curentul electric sau de a muta sarcini electrice în interiorul acesteia. Acesta este raportul dintre densitatea curentului și intensitatea câmpului electric. Dacă luăm în considerare un cub de material conductiv cu latura de 1 metru, atunci conductivitatea va fi egală cu conductivitatea electrică măsurată între două laturi opuse ale acestui cub.
Experții consideră această descoperire foarte interesantă și stimulatoare. Datele obținute ar trebui să inspire cercetări ulterioare asupra funcțiilor sensibilității electrice nu numai a ampulei lui Lorenzini, ci și a diferitelor organe în general. Astfel de date nu sunt de obicei disponibile. Nu numai că această descoperire ar trebui să conducă la dezvoltarea de noi tipuri de senzori de diferite tipuri.
Substanțele cu aceeași temperatură par diferit calde. Dacă atingem lemnul și metalul la aceeași temperatură, metalul va părea rece pentru că ne face căldura din ce în ce mai caldă, deoarece suprafața noastră este încălzită de mâna noastră.
Conductivitatea specifică este legată de conductivitate prin următoarea formulă:
G = σ(A/l)
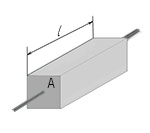
Unde G- conductivitate electrica, σ - conductivitate electrică specifică, O- secţiunea transversală a conductorului perpendicular pe direcţia curent electricŞi l- lungimea conductorului. Această formulă poate fi utilizată cu orice conductor în formă de cilindru sau prismă. Rețineți că această formulă poate fi folosită și pentru un paralelipiped dreptunghiular, deoarece este un caz special al unei prisme, a cărei bază este un dreptunghi. Să ne amintim că conductivitatea electrică este reciproca rezistivității electrice.
Conductivitatea termică este capacitatea unui material de a se încălzi. De fapt, este viteza cu care căldura se răspândește de la o parte încălzită a țesăturii la alta, mai rece. Conductivitatea termică a fiecărei substanțe este determinată de coeficientul de conductivitate termică. În funcție de valoarea coeficientului de conductivitate termică, distingem între conductivitate termică bună și proastă.
Toate metalele au o conductivitate termică mai bună. O mai bună disipare a căldurii are ca rezultat metale pure decât metalele sau aliajele contaminate. Metalul, care este cel mai bun conductor electric, este și cel mai bun conductor termic. Relația dintre coeficientul de conductivitate termică și coeficientul de conductivitate este exprimată în legea Lorentz-Lorentz. Conductivitatea termică și electrică a metalelor este mediată de electroni liberi. Buna conductivitate termică a metalelor este utilizată în tehnologie, radiatoare metalice, pereți cazanelor cu abur, corpuri de răcire etc. alte solide sunt conductoare termice slabe, cu excepția solidelor.
Poate fi dificil pentru oamenii departe de fizică și tehnologie să înțeleagă diferența dintre conductivitatea unui conductor și conductivitatea specifică a unei substanțe. Între timp, desigur, acestea sunt diferite mărimi fizice. Conductibilitatea este o proprietate a unui conductor sau dispozitiv dat (de exemplu, un rezistor sau baie galvanică), în timp ce conductivitatea este o proprietate inerentă a materialului din care este realizat acest conductor sau dispozitiv. De exemplu, conductivitatea cuprului este întotdeauna aceeași, indiferent de modul în care se schimbă forma și dimensiunea unui obiect de cupru. În același timp, conductivitatea fir de cupru depinde de lungimea, diametrul, masa, forma și de alți factori. Desigur, obiectele similare realizate din materiale cu conductivitate mai mare au o conductivitate mai mare (deși nu întotdeauna).
Experiență practică: conductoarele de căldură foarte slabe sunt gazele și lichidele, în special apa. Încălzind apa din partea de sus a tubului, o putem aduce la fierbere în timp ce lăsăm fundul rece. Gazele au cei mai mici coeficienți de conductivitate termică. În consecință, și substanțele poroase libere care conțin aer în interior sunt conductoare termice slabe. Conductivitatea unor astfel de substanțe depinde de umiditate, astfel încât conductivitatea termică a substanțelor umede este mult mai mare. Pentru izolarea termică se folosesc substanțe care sunt slabe conductoare de căldură.

În Sistemul Internațional de Unități (SI), unitatea de conductivitate electrică este Siemens pe metru (S/m). Unitatea de conductivitate inclusă în ea este numită după savantul, inventatorul și antreprenorul german Werner von Siemens (1816–1892). Compania Siemens AG (Siemens) fondată de el în 1847 este una dintre cele mai multe marile companii, producând echipamente electrice, electronice, energetice, de transport și medicale.
Cel mai bun izolator termic este vidul. Animalele cu sânge cald își încălzesc corpul pentru a-și izola corpul pentru a-și menține temperatura cu energie minimă. Animalele cu sânge rece, pe de altă parte, își vindecă corpul din surse externe. Izolatie termica pot interfera cu ele. Rața sau cetaceele le folosesc grăsime subcutanată pentru izolare termica.
Materiale inteligente pentru noul secol. Numitorul comun al acestui premiu Nobel este munca a trei oameni de știință care a condus la descoperirea și dezvoltarea unei noi clase de substanțe - polimerii conducători. Polimerii conducători combină comportamentul electric tipic semiconductorilor cu proprietățile materialelor care îi fac mai ușor de prelucrat. Ele își pot schimba structura și, prin urmare, în funcție de reacția la mediu- lor proprietăți fizice. De aceea se numesc materiale inteligente. Atributul „inteligent” este exagerat, dar comportamentul materialelor conductoare electric îl face util.

Gama de conductivitate electrica este foarte larga: de la materiale cu rezistivitate mare precum sticla (care, de altfel, conduce bine electricitatea daca este incalzita in rosu) sau metacrilatul de polimetil (plexiglas) pana la conductori foarte buni precum argintul, cuprul sau aurul. Conductivitatea electrică este determinată de numărul de sarcini (electroni și ioni), viteza cu care se mișcă și cantitatea de energie pe care o pot transporta. Soluțiile apoase de diferite substanțe, care sunt utilizate, de exemplu, în băile de placare, au valori medii de conductivitate. Un alt exemplu de electroliți cu valori medii de conductivitate este mediul intern al corpului (sânge, plasmă, limfă și alte fluide).
Polimerii sunt cunoscuți în mod obișnuit ca izolatori. Au bine proprietăți mecaniceși sunt ușor de procesat. Sunt folosite ca izolatori conductoare electrice, izolatori termici sau straturi fonoabsorbante. Ele au, de asemenea, avantajul de a fi cu densitate redusă și, prin urmare, sunt din ce în ce mai utilizate în industriile în care se dorește o greutate redusă a materialului, cum ar fi aeronautica sau ambalajul. Pentru multe aplicații, proprietățile funcționale ale polimerilor pot fi îmbunătățite prin producerea de compozite, adică polimeri care conțin diferite materiale de umplutură.
Conductivitatea metalelor, semiconductorilor și dielectricilor este discutată în detaliu în următoarele articole ale site-ului web Physical Quantity Converter: și Conductivitate electrică. În acest articol vom discuta mai detaliat conductivitatea specifică a electroliților, precum și metodele și echipamentele simple pentru măsurarea acesteia.
Conductivitatea electrică specifică a electroliților și măsurarea acesteia

De exemplu, se realizează straturi fotosensibile pentru xerografe și imprimante laser, detectoare piezoelectrice și piroelectrice sau fotocopiatoare. În compozitele care conțin negru de fum sau grafit sub formă de pulbere, conductivitatea electrică a fost crescută semnificativ. Astfel de materiale sunt potrivite, de exemplu, pentru producția de cutii de ulei ușoare - compozitul conductiv asigură o sarcină electrostatică, astfel încât nu există riscul de aprindere a vaporilor volatili.
Pe lângă compozitele conductoare, există și polimeri conjugați care își pot prezenta o conductivitate electrică ridicată. Acest lucru permite rotația regulată a legăturilor simple și duble structura moleculara. Pe lângă sistemul acestor legături, o condiție prealabilă este prezența purtătorilor de sarcină mobili care mediază transportul în lanț conjugat.
Conductivitatea specifică a soluțiilor apoase în care apare un curent electric ca urmare a mișcării ionilor încărcați este determinată de numărul de purtători de sarcină (concentrația substanței în soluție), viteza de mișcare a acestora (mobilitatea ionilor). depinde de temperatură) și de sarcina pe care o poartă (determinată de valența ionilor). Prin urmare, în majoritatea soluțiilor apoase, o creștere a concentrației duce la o creștere a numărului de ioni și, în consecință, la o creștere a conductivității. Cu toate acestea, după atingerea unui anumit maxim, conductivitatea specifică a soluției poate începe să scadă odată cu o creștere suplimentară a concentrației soluției. Prin urmare, soluțiile cu două concentrații diferite ale aceleiași sare pot avea aceeași conductivitate.
Din punct de vedere structural, cel mai simplu polimer conjugat este poliacetilena. Descoperirea fundamentală a acestor experți a fost aceea de a descoperi că atunci când o peliculă subțire de poliacetilenă este dopată cu vapori de iod, conductivitatea electrică a peliculei crește de aproximativ un milion de ori. Un electron este îndepărtat din lanțul polimeric. După transferul de electroni din lanțul de poliacetilenă la molecula de iod, care este încărcată negativ, molecula de poliacetilenă poartă o sarcină pozitivă. Diferența semnificativă dintre semiconductorii anorganici și organici dopați este că putem afecta în mod semnificativ proprietățile electrice ale materialului la concentrații de dopanți urme, pentru substanțele anorganice avem nevoie de o concentrație mai mare pentru polimeri.
Temperatura afectează, de asemenea, conductibilitatea, deoarece pe măsură ce temperatura crește, ionii se mișcă mai repede, rezultând o conductivitate crescută. Apă curată- un slab conductor de electricitate. Apa distilată obișnuită, care conține în stare de echilibru dioxid de carbon din aer si mineralizare totala mai mica de 10 mg/l, are o conductivitate electrica specifica de circa 20 mS/cm. Conductivitatea specifică a diferitelor soluții este dată în tabelul de mai jos.
Pentru transferul de sarcină electrică, depășirea purtătorilor între circuite este un factor determinant. Acest transport este mai puțin eficient decât transportul de sarcină în metale, deoarece este foarte dependent de ordinea macromoleculelor. Dovada este că filmele orientate mecanic prezintă o conductivitate electrică mai mare în direcția de alungire decât probele originale.
Munca celor trei laureați rămâne punctul culminant al cercetării începute în anii 1950. Unii cercetători au început deja să studieze transferul de electroni în substanțe cu molecul scăzut și formarea sărurilor conducătoare. În anii 1960, Hideo Akamatu și Hiro Inokuchi au scris monografia Organic Semiconductor, în care sistemele reale arătau că moleculele mici pot crea conductori și chiar supraconductori. În căutarea unor substanțe potrivite au fost sintetizate sute de materiale organice cu conductivitate electrică crescută, dar până acum a fost imposibil să se pregătească un polimer adecvat.


Pentru a determina conductivitatea specifică a unei soluții, se folosește un contor de rezistență (ohmmetru) sau conductivitate. Acestea sunt dispozitive aproape identice, care diferă doar prin scară. Ambele măsoară căderea de tensiune pe secțiunea circuitului prin care curge curentul electric din bateria dispozitivului. Valoarea măsurată a conductivității este convertită manual sau automat în conductivitate specifică. Acest lucru se face ținând cont caracteristici fizice dispozitiv de măsurare sau senzor. Senzorii de conductivitate sunt proiectați simplu: sunt o pereche (sau două perechi) de electrozi scufundați într-un electrolit. Senzorii pentru măsurarea conductibilității se caracterizează prin constanta senzorului de conductivitate, care în cel mai simplu caz este definit ca raportul dintre distanța dintre electrozi D pe zona (electrodul) perpendiculară pe fluxul de curent O
Negrul de anilină este cunoscut de secole. Din cauza dificultăților de sinteză, a început să se acorde atenție celui mai simplu model de polimer - poliacetilena. Are două conformații, forma trans și cis. Sinteza dă un amestec al acestora. Din punct de vedere al conductivității electrice, este interesantă doar transformarea obținută de Hideki Shirakawa în forma sa pură film polimeric argint L-a ajutat prin coincidență - a folosit un catalizator diverse tipuri pentru polimerizare decât de obicei, plus o miime de concentrație.
În cealaltă parte a lumii, MacDiarmid și colegul său Heger se uitau la acea vreme la proprietățile unui polimer anorganic format din atomi de sulf și azot, pe care l-au transformat într-o peliculă similară cu o peliculă de metal. Proprietățile acestui polimer au fost raportate de MacDiarmid la o întâlnire științifică din Tokyo, unde l-a cunoscut pe Shirakawa. Au fost de acord să înceapă să lucreze împreună la Universitatea din Pennsylvania. Trans-poliacetilena a fost însămânțată cu iod și a fost studiată conductivitatea electrică a acestuia.
Această formulă funcționează bine dacă aria electrozilor este semnificativ mai mare decât distanța dintre ei, deoarece în acest caz cele mai multeîntre electrozi circulă curent electric. Exemplu: pentru 1 centimetru cub de lichid K = D/A= 1 cm/1 cm² = 1 cm⁻¹. Rețineți că senzorii de conductivitate cu electrozi mici distanțați pe o distanță relativ mare sunt caracterizați de valori constante ale senzorului de 1,0 cm⁻¹ și mai mari. În același timp, senzorii cu electrozi relativ mari, amplasați unul lângă celălalt, au o constantă de 0,1 cm⁻¹ sau mai puțin. Senzor constantă pentru măsurarea conductibilității electrice diverse dispozitive variază de la 0,01 la 100 cm⁻¹.
Rezultatul a fost o serie de locuri de muncă și companii care au îmbunătățit apoi procesele chimice și au crescut conductivitatea electrică. Deși poliacetilena este foarte conductivă, apropiindu-se de cea a metalelor, nu este potrivită pentru o utilizare mai largă și are o rezistență slabă la intemperii. Prin urmare, interesul cercetătorilor încă de la mijlocul anilor 80 s-a concentrat asupra altor polimeri conjugați - polipirol, politiofen, polianilină, polifenilenă, poli.
Polianilina este probabil cel mai vechi polimer organic creat de om. Fritsche, care la scurt timp după obținerea anilinei a căutat să creeze noi coloranți sintetici. Lathby a descris oxidarea electrochimică a anilinei, care și-a schimbat culoarea în albastru după ce a fost împinsă cu alcalii.

Constanta teoretică a senzorului: stânga - K= 0,01 cm⁻¹, dreapta - K= 1 cm⁻¹
Pentru a obține conductivitatea din conductibilitatea măsurată, se utilizează următoarea formulă:
σ = K ∙ G
σ - conductivitatea specifică a soluției în S/cm;
K- constanta senzorului in cm⁻¹;
G- conductivitatea senzorului la siemens.
Constanta senzorului nu este de obicei calculată din dimensiunile sale geometrice, ci este măsurată într-un anumit aparat de masura sau într-o configurație specifică de măsurare folosind o soluție de conductivitate cunoscută. Această valoare măsurată este introdusă în contorul de conductivitate, care calculează automat conductibilitatea din valorile măsurate de conductivitate sau rezistență ale soluției. Datorită faptului că conductivitatea depinde de temperatura soluției, dispozitivele pentru măsurarea acesteia conțin adesea un senzor de temperatură care măsoară temperatura și asigură compensarea automată a temperaturii măsurătorilor, adică normalizarea rezultatelor la o temperatură standard de 25 ° C .
Cel mai simplu mod de a măsura conductivitatea este aplicarea unei tensiuni la doi electrozi plati scufundați într-o soluție și măsurarea curentului care curge. Această metodă se numește potențiometrică. Conform legii lui Ohm, conductivitatea G este raportul dintre curent eu la tensiune U:
Cu toate acestea, nu totul este la fel de simplu precum este descris mai sus - există multe probleme la măsurarea conductivității. Dacă se folosește curent continuu, ionii se colectează la suprafețele electrozilor. De asemenea, suprafețele electrozilor pot experimenta reacție chimică. Acest lucru duce la o creștere a rezistenței de polarizare pe suprafețele electrozilor, ceea ce, la rândul său, duce la rezultate eronate. Dacă încercați să măsurați rezistența, de exemplu, a unei soluții de clorură de sodiu cu un tester convențional, veți vedea clar cum citirile de pe afișajul unui dispozitiv digital se schimbă destul de repede în direcția creșterii rezistenței. Pentru a elimina influența polarizării, este adesea folosit un design de senzor de patru electrozi.
Polarizarea poate fi, de asemenea, prevenită, sau cel puțin redusă, dacă este utilizată în măsurare ACîn loc de constantă și chiar reglați frecvența în funcție de conductivitate. Frecvențele joase sunt folosite pentru a măsura conductivitatea scăzută, unde influența polarizării este mică. Frecvențele mai înalte sunt utilizate pentru a măsura conductivități mari. De obicei, frecvența este ajustată automat în timpul procesului de măsurare, ținând cont de valorile de conductivitate obținute ale soluției. Conductivitățile digitale moderne cu doi electrozi utilizează de obicei forme de undă complexe ale curentului alternativ și compensarea temperaturii. Ele sunt calibrate din fabrică, dar recalibrarea este adesea necesară în timpul funcționării, deoarece constanta celulei de măsurare (senzor) se modifică în timp. De exemplu, se poate schimba atunci când senzorii se murdăresc sau când electrozii suferă modificări fizice și chimice.
Într-un contor de conductivitate tradițional cu doi electrozi (acesta este cel pe care îl vom folosi în experimentul nostru), se aplică o tensiune alternativă între doi electrozi și se măsoară curentul care curge între electrozi. Această metodă simplă are un dezavantaj - nu se măsoară doar rezistența soluției, ci și rezistența cauzată de polarizarea electrozilor. Pentru a minimiza influența polarizării, se utilizează un design cu patru electrozi a senzorului, precum și acoperirea electrozilor cu negru de platină.
Mineralizare generală
Dispozitivele de măsurare a conductibilității electrice sunt adesea folosite pentru a determina mineralizarea totală sau conținutul de solide(ing. solide dizolvate totale, TDS). Este o măsură a cantității totale de substanțe organice și anorganice conținute într-un lichid sub diferite forme: ionizate, moleculare (dizolvate), coloidale și în suspensie (nedizolvate). Soluțiile includ orice săruri anorganice. În principal, acestea sunt cloruri, bicarbonați și sulfați de calciu, potasiu, magneziu, sodiu, precum și unele substanțe organice dizolvate în apă. Pentru a fi clasificate ca mineralizare totală, substanțele trebuie să fie fie dizolvate, fie sub formă de particule foarte fine care trec prin filtre cu diametrul porilor mai mic de 2 micrometri. Sunt numite substanțe care sunt suspendate constant în soluție, dar nu pot trece printr-un astfel de filtru solide în suspensie(ing. solide în suspensie totale, TSS). Solidele totale în suspensie sunt de obicei măsurate pentru a determina calitatea apei.

Există două metode de măsurare a conținutului de solide: analiza gravimetrică, care este cel mai mult metoda precisa, Și masurarea conductibilitatii. Prima metodă este cea mai precisă, dar necesită mult timp și echipament de laborator, deoarece apa trebuie evaporată pentru a obține un reziduu uscat. Acest lucru se face de obicei la o temperatură de 180°C conditii de laborator. După evaporarea completă, reziduul este cântărit pe o cântar de precizie.
A doua metodă nu este la fel de precisă ca analiza gravimetrică. Cu toate acestea, este foarte convenabil, răspândit și este cel mai metoda rapida, deoarece este o masurare simpla a conductibilitatii si a temperaturii realizata in cateva secunde cu un instrument de masura ieftin. Metoda de măsurare a conductibilității electrice specifice poate fi utilizată datorită faptului că conductibilitatea specifică a apei depinde direct de cantitatea de substanțe ionizate dizolvate în ea. Această metodă potrivite în special pentru controlul calității apă potabilă sau estimarea numărului total de ioni dintr-o soluție.
Conductivitatea măsurată depinde de temperatura soluției. Adică, cu cât temperatura este mai mare, cu atât conductivitatea este mai mare, deoarece ionii dintr-o soluție se mișcă mai repede pe măsură ce temperatura crește. Pentru a obține măsurători independente de temperatură, se folosește conceptul de temperatură standard (de referință) la care rezultatele măsurătorilor sunt reduse. Temperatura de referință vă permite să comparați rezultatele obținute la temperaturi diferite. Astfel, un conductimetru poate măsura conductivitatea reală și apoi poate folosi o funcție de corecție care va ajusta automat rezultatul la o temperatură de referință de 20 sau 25°C. Dacă este necesară o precizie foarte mare, proba poate fi plasată într-un incubator, apoi contorul poate fi calibrat la aceeași temperatură care va fi utilizată în măsurători.
Majoritatea contoarelor de conductivitate moderne au un senzor de temperatură încorporat, care este utilizat atât pentru corectarea temperaturii, cât și pentru măsurarea temperaturii. Cele mai avansate instrumente sunt capabile să măsoare și să afișeze valorile măsurate în unități de conductivitate, rezistivitate, salinitate, salinitate totală și concentrație. Cu toate acestea, remarcăm din nou că toate aceste dispozitive măsoară doar conductivitatea (rezistența) și temperatura. Toate mărimile fizice afișate pe afișaj sunt calculate de dispozitiv ținând cont de temperatura măsurată, care este utilizată pentru compensarea automată a temperaturii și aducerea valorilor măsurate la o temperatură standard.
Experiment: măsurarea mineralizării totale și a conductivității
În cele din urmă, vom efectua mai multe experimente pentru a măsura conductivitatea folosind un contor de mineralizare totală ieftin TDS-3 (numit și salinometru, salinometru sau contor de conductivitate). Prețul dispozitivului TDS-3 „fără nume” de pe eBay, inclusiv livrarea la momentul scrierii, este mai mic de 3,00 USD. Exact același dispozitiv, dar cu numele producătorului, costă de 10 ori mai mult. Dar aceasta este pentru cei cărora le place să plătească pentru marcă, deși există o probabilitate foarte mare ca ambele dispozitive să fie produse în aceeași fabrică. TDS-3 efectuează compensarea temperaturii și în acest scop este echipat cu un senzor de temperatură situat lângă electrozi. Prin urmare, poate fi folosit și ca termometru. Trebuie remarcat încă o dată că dispozitivul nu măsoară de fapt mineralizarea în sine, ci rezistența dintre doi electrozi de sârmă și temperatura soluției. Acesta calculează automat orice altceva folosind factori de calibrare.

Un contor de mineralizare totală vă poate ajuta să determinați conținutul de solide, de exemplu atunci când monitorizați calitatea apei potabile sau determinați salinitatea apei dintr-un acvariu sau un iaz de apă dulce. Poate fi folosit și pentru a monitoriza calitatea apei în sistemele de filtrare și purificare a apei pentru a ști când este timpul să înlocuiți filtrul sau membrana. Instrumentul este calibrat din fabrică cu o soluție de clorură de sodiu de 342 ppm (părți per milion sau mg/L), NaCl. Domeniul de măsurare al dispozitivului este 0–9990 ppm sau mg/l. PPM - părți pe milion, unitate de măsură fără dimensiuni valori relative, egal cu 1 10⁻⁶ din linia de bază. De exemplu, o concentrație de masă de 5 mg/kg = 5 mg în 1.000.000 mg = 5 ppm sau ppm. La fel cum un procent este o sutime, un ppm este o milioneme. Procentele și ppm au sens foarte asemănător. Părțile pe milion, spre deosebire de procente, sunt utile pentru a indica concentrația soluțiilor foarte slabe.
Dispozitivul măsoară conductivitatea electrică dintre doi electrozi (adică reciproca rezistenței), apoi transformă rezultatul în conductivitate electrică specifică (în literatura engleză se folosește adesea abrevierea EC) folosind formula de conductivitate de mai sus, ținând cont de constanta senzorului. K, apoi efectuează o altă conversie înmulțind conductivitatea rezultată cu un factor de conversie de 500. Rezultatul este o valoare totală a salinității în părți per milion (ppm). Mai multe detalii despre asta mai jos.
Acest contor de mineralizare totală nu poate fi utilizat pentru a testa calitatea apei cu conținut ridicat de sare. Exemple de substanțe cu conținut ridicat de sare sunt unele alimente (supă obișnuită cu un conținut normal de sare de 10 g/l) și apa de mare. Concentrația maximă de clorură de sodiu pe care o poate măsura acest dispozitiv este de 9990 ppm sau aproximativ 10 g/l. Aceasta este concentrația tipică de sare în produse alimentare. De asemenea, acest dispozitiv nu poate măsura salinitatea. apa de mare, deoarece este de obicei 35 g/l sau 35.000 ppm, ceea ce este mult mai mare decât poate măsura dispozitivul. Dacă încercați să măsurați o concentrație atât de mare, instrumentul va afișa mesajul de eroare Err.
Contorul de salinitate TDS-3 măsoară conductivitate specifică și utilizează așa-numita „scara 500” (sau „scara NaCl”) pentru calibrare și conversie în concentrație. Aceasta înseamnă că pentru a obține concentrația ppm, valoarea conductibilității în mS/cm este înmulțită cu 500. Adică, de exemplu, 1,0 mS/cm este înmulțit cu 500 pentru a obține 500 ppm. Diferitele industrii folosesc scări diferite. De exemplu, în hidroponie se folosesc trei cântare: 500, 640 și 700. Singura diferență dintre ele este în utilizare. Scara 700 se bazează pe măsurarea concentrației de clorură de potasiu într-o soluție și conversia conductibilității specifice în concentrație se realizează după cum urmează:
1,0 mS/cm x 700 dă 700 ppm
Scala 640 utilizează un factor de conversie de 640 pentru a converti mS în ppm:
1,0 mS/cm x 640 dă 640 ppm
În experimentul nostru, vom măsura mai întâi mineralizarea totală a apei distilate. Contorul de salinitate arată 0 ppm. Multimetrul prezintă o rezistență de 1,21 MOhm.

Pentru experiment, vom prepara o soluție de clorură de sodiu NaCl cu o concentrație de 1000 ppm și vom măsura concentrația folosind TDS-3. Pentru a prepara 100 ml de soluție, trebuie să dizolvăm 100 mg de clorură de sodiu și să adăugăm apă distilată la 100 ml. Se cântăresc 100 mg de clorură de sodiu și se pun într-un cilindru dozator, se adaugă puțină apă distilată și se amestecă până când sarea este complet dizolvată. Apoi adăugați apă până la semnul de 100 ml și amestecați din nou bine.
Pentru a determina experimental conductivitatea, am folosit doi electrozi din același material și cu aceleași dimensiuni ca și electrozii TDS-3. Rezistența măsurată a fost de 2,5 KOhm.
Acum că știm rezistența și concentrația ppm de clorură de sodiu, putem calcula aproximativ constanta celulară a salinității TDS-3 folosind formula de mai sus:
K = σ/G= 2 mS/cm x 2,5 kOhm = 5 cm⁻1
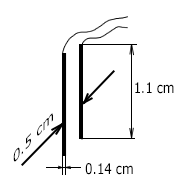
Această valoare de 5 cm⁻¹ este aproape de valoarea constantă calculată a celulei de măsurare TDS-3 cu dimensiunile electrodului indicate mai jos (vezi figura).
- D = 0,5 cm - distanta dintre electrozi;
- L = 0,14 cm - lățimea electrozilor
- L = 1,1 cm - lungimea electrozilor
Constanta senzorului TDS-3 este K = D/A= 0,5/0,14x1,1 = 3,25 cm⁻¹. Aceasta nu este cu mult diferită de valoarea obținută mai sus. Să reamintim că formula de mai sus permite doar o estimare aproximativă a constantei senzorului.
Vi se pare dificil să traduceți unitățile de măsură dintr-o limbă în alta? Colegii sunt gata să vă ajute. Postați o întrebare în TCTermsși în câteva minute vei primi un răspuns.
Vă amintiți de la cursul de fizică că rezistența electrică a oricărui conductor poate fi calculată folosind formula:
unde R este rezistența în Ohmi;
l - lungimea conductorului, cm;
S - aria secțiunii transversale, cm 2;
r- rezistivitate, adică rezistența unui conductor de 1 cm lungime cu o suprafață a secțiunii transversale de 1 cm 2.
În electrochimie, se obișnuiește să se utilizeze cantitățile reciproce indicate:
Mărimea L se numește conductivitate electrică și se măsoară în Siemens (Sm) Sm = Ohm -1.
Mărimea À se numește conductivitate electrică specifică. Este ușor de dedus că valoarea À se măsoară în cm×cm -1. În Fig. 3.1. este prezentată o celulă conductometrică utilizată pentru măsurarea conductivității electrice. Este un vas 1, fără fund, în care sunt introduși doi electrozi de platină 2, plasați în soluția de testare 3.
Valoarea lui K se determină experimental. Pentru a face acest lucru, este necesar să se măsoare conductivitatea electrică L a unei soluții pentru care se cunoaște À. De obicei, în acest scop sunt utilizate soluții de clorură de potasiu cu concentrație cunoscută (0,1; 0,05; 0,01 mol/dm 3), ale căror valori sunt disponibile în tabele.
Din ecuația (3.5.) rezultă că
Conductivitatea specifică este conductivitatea electrică a unei soluții plasate între doi electrozi cu o suprafață de 1 cm2, situat la o distanta de 1 cm.
| À HCl KOH HF CH 3 COOH C Fig. 3.2 Dependența conductibilității specifice de concentrație | Conductivitatea electrică specifică a unei soluții depinde de natura solventului și a solutului, de concentrația soluției și de temperatură. În Fig. 3.2. sunt prezentate grafice ale dependenței lui À de concentrația soluțiilor apoase ale unor electroliți la o temperatură constantă Din figură, în primul rând, rezultă că la concentrații egale de soluții, conductivitatea soluțiilor de electroliți puternici este mult mai mare. deoarece ele contin |
mai mulți ioni care transportă electricitate. În soluțiile diluate de electroliți puternici și slabi, o creștere a concentrației duce la o creștere a conductibilității, care este asociată cu o creștere a numărului de ioni. În regiunea concentrațiilor mari se observă o scădere a lui À. Pentru electroliții puternici, acest lucru se datorează unei creșteri a vâscozității soluțiilor și unei creșteri a interacțiunii electrostatice dintre ioni. Pentru electroliții slabi, acest efect este asociat cu o scădere a gradului de disociere și, în consecință, cu o scădere a numărului de ioni.
Pe măsură ce temperatura crește, conductivitatea specifică a electroliților crește:
А 2 = А 1 [ 1 + a(T 2 - T 1)] (3.7.)
În această ecuație, À 1 și À 2 sunt conductivitatea la temperaturile T 1 și T 2, iar a este coeficientul de temperatură al conductibilității. De exemplu, pentru săruri a » 0,02. Aceasta înseamnă că o creștere cu un grad a temperaturii are ca rezultat o creștere a conductibilității cu aproximativ 2%. Acest lucru se datorează faptului că odată cu creșterea temperaturii gradul de hidratare și vâscozitatea soluțiilor scad.
Trebuie remarcat faptul că, spre deosebire de electroliți, conductivitatea electrică a metalelor scade odată cu creșterea temperaturii.
Conductivitate electrică molară
Conductivitatea molară l este legată de conductibilitatea specifică prin formula:
l = À×1000/s (3,8.)
În această expresie, c este concentrația molară a soluției, mol×dm -3. Conductivitatea molară este exprimată în cm×cm 2 ×mol -1. Aşa,
conductivitatea molară este conductivitatea unei soluții care conține 1 mol dintr-o substanță la o distanță între electrozi de 1 cm.
Conductivitatea electrică molară atât a electroliților puternici, cât și a celor slabi scade odată cu creșterea concentrației. Natura dependenței lui l de c pentru electroliții puternici și slabi este diferită, deoarece influența concentrării se datorează diverselor motive.
Electroliți puternici. La concentrații scăzute, dependența conductivității molare de concentrație este exprimată prin ecuația empirică Kohlrausch:
l = l 0 –bÖс (3.9.)
unde b este o constantă determinată experimental,
și l 0 – conductivitate electrică molară la diluție infinită sau conductivitate molară limită.
Astfel,
liml C ® 0 = l 0 (3.10.)
Este imposibil să se pregătească o soluție a cărei concentrație este zero. Valoarea lui l 0 pentru electroliții puternici poate fi determinată grafic. Din ecuația (3.9.) rezultă că graficul lui l = f(Öc) pentru electroliții puternici este o linie dreaptă (Fig. 3.3., linia 1).
Dacă pregătiți o serie de soluții de diferite concentrații, măsurați conductivitatea lor L, calculați și reprezentați grafic l = f(Öc), apoi extrapolând dreapta rezultată la ordonată (c = 0), puteți determina l 0. Dacă luăm în considerare că electroliții puternici, indiferent de concentrația soluției, sunt complet disociați, ajungem la concluzia că numărul de ioni formați dintr-un mol dintr-o substanță este întotdeauna același. Aceasta înseamnă că viteza de mișcare a ionilor depinde de concentrația soluției, cu creșterea concentrației; inhibarea ionilor. Acest fenomen este asociat cu formarea în jurul fiecărui ion în soluție atmosfera ionică, constând predominant din ioni de semn opus. Pe măsură ce concentrația crește, crește și vâscozitatea soluției. Există și alte motive pentru încetinirea mișcării ionilor în câmp electric, pe care nu ne vom opri.
Dacă determinați experimental valoarea lui l pentru o soluție de o concentrație dată și găsiți grafic l 0, puteți calcula valoarea coeficientului de conductivitate electrică f :
f= l / l 0 (3,11.)
Coeficient f caracterizează gradul de inhibiție a ionilor și tinde spre unitate atunci când soluția este diluată.
Electroliți slabi. Conductivitatea molară a electroliților slabi este semnificativ mai mică decât a soluțiilor de electroliți puternici (Fig. 3.3, linia 2). Acest lucru se datorează faptului că, chiar și la concentrații scăzute, gradul de disociere a electroliților slabi este mic. O creștere a conductivității molare a electroliților slabi atunci când soluțiile sunt diluate este asociată cu o creștere a gradului de disociere în conformitate cu legea diluției lui Ostwald. S. Arrhenius a sugerat că conductivitatea molară a unui electrolit slab este legată de gradul său de disociere prin expresia:
o= l / l 0 (3,12.)
Astfel, gradul de disociere a unui electrolit slab poate fi calculat dacă este cunoscută conductivitatea molară maximă l 0 a acestuia. Cu toate acestea, este imposibil să se determine l 0 grafic prin extrapolarea graficului l = f(Öc), deoarece curba (Fig. 3.3., linia 2) cu concentrație în scădere se apropie asimptotic de ordonată.
Valoarea l 0 poate fi determinată folosind legea independența mișcării ionice Kohlrausch:
Conductivitatea electrică molară a electrolitului cu diluția infinită a soluției este egală cu suma mobilităților maxime ale cationilor și anionilor.
l 0 =l 0,+ + l 0,– (3.13.)
Mobilitățile cationului și anionului sunt proporționale cu vitezele absolute de mișcare a ionilor (vezi Tabelul 3.1.).
l 0,+ = F×U + ; l 0,– = F×U – (3.14.)
În aceste formule, F este o unitate de electricitate numită Faraday, egală cu 96494 Coulombs (C). În tabelul 3.2. Este dată mobilitatea maximă a unor ioni.
Trebuie remarcat faptul că legea independenței mișcării ionilor este valabilă atât pentru electroliții slabi, cât și pentru cei puternici.
Tabelul 3.2.
Limitarea mobilității ionilor (cm 2 × Cm × mol -1) la 25 0 C
| Cation | l 0,+ | Anion | l 0,– |
| H + K + Na + Li + Ag + Ba2+ Ca2+ Mg2+ | 349,8 73,5 50,1 38,7 61,9 127,2 119,0 106,1 | OH - I - Br - Cl - NO 3 - CH 3 COO - SO 4 2- | 76,8 78,4 76,3 71,4 40,9 160,0 |
Aplicații ale măsurătorilor de conductivitate
Se numește o metodă de cercetare bazată pe măsurarea conductibilității electrice conductometrie. Această metodă este utilizată pe scară largă în practica de laborator. Se numește un dispozitiv pentru măsurarea conductibilității electrice conductimetru. În special, metoda conductometrică face posibilă determinarea constantelor de disociere ale electroliților slabi.
Exemplu. Determinarea constantei de disociere a acidului acetic.
a) Pentru a afla constanta celulei conductometrice, am pregătit soluții de clorură de potasiu cu concentrații molare de 0,1 și 0,02 mol×dm -3 și am măsurat conductivitatea acestora. Sa dovedit a fi egală cu L 1 = 0,307 S și L 2 = 0,0645 S, respectiv, în tabel găsim valorile conductivității specifice a soluțiilor de clorură de potasiu ale concentrațiilor indicate:
À 1 = 1,29×10 -1 Sm×cm -1 ; À 2 = 2,58×10 -2 Sm×cm -1
Conform ecuației 3.6. Calculăm constanta celulei:
K 1 = À 1 /L 1 = 0,42 cm -1
K 2 = À 2 /L 2 = 0,40 cm -1
Valoarea medie K = 0,41 cm -1
b) Am preparat două soluții de acid acetic cu concentrațiile c 1 = 0,02 mol × dm -3 și c 2 = 1 × 10 -3 mol × dm -3. Cu ajutorul unui conductometru, conductivitatea lor electrică a fost măsurată:
L 1 = 5,8×10 -4 cm; L 2 = 1,3 × 10 -4 Vezi.
c) Calculați conductivitatea specifică:
À 1 = L 1 ×K = 5,8×10 -4 ×0,41 = 2,378×10 -4 Cm×cm -1
À 2 = L 2 ×K = 1,2×10 -4 ×0,41 = 0,492×10 -4 Sm×cm -1
d) Utilizând formula (3.8.) găsim conductivitatea electrică molară l 1 = 11,89 Sm × cm 2 × mol -1; l 2 = 49,2 cm×cm 2 ×mol -1
e) Găsim folosind tabelul 3.2. valoarea conductivității molare maxime a acidului acetic: l 0 = 349,8 +40,9 = 390,7 Sm×cm 2 ×mol -1.
e) În final, pentru fiecare soluție se calculează gradul de disociere (ecuația 3.12.) și constanta de disociere
a 1 = 3,04×10 -2; a 2 = 1,26×10 -1
K1 = 1,91×10-5; K 2 = 1,82×10 -5
Valoarea medie K = 1,86×10 -5
