Vyuma vya conductive. Conductivity ya umeme
Urefu na umbali Vipimo vya wingi wa vitu vizito na vyakula kwa wingi Eneo la Kiasi na vitengo vya kipimo katika mapishi ya upishi Shinikizo la joto, mkazo wa mitambo, moduli ya Young Nishati na kazi Muda wa Nguvu ya Nguvu Muda Kasi ya mstari Pembe ya ndege Ufanisi wa joto na ufanisi wa mafuta Hesabu Vitengo vya kupima kiasi cha habari Viwango vya kubadilishana Ukubwa wa nguo na viatu vya wanawake Ukubwa wa nguo na viatu vya wanaume Kasi ya angular na kasi ya mzunguko. Kuongeza kasi ya Angular kuongeza kasi Msongamano Kiasi mahususi Muda wa hali ya hewa Muda wa ajizi Muda wa nguvu Torque Joto mahususi la mwako (kwa wingi) Uzito wa nishati na joto maalum la mwako wa mafuta (kwa kiasi) Tofauti ya joto Mgawo wa upanuzi wa joto Upinzani wa joto. Joto maalum Mfiduo wa nishati, nguvu ya mionzi ya joto Mgawo wa mtiririko wa joto Mgawo wa uhamishaji joto Mgawo wa uhamishaji wa joto Mtiririko wa wingi Mtiririko wa molekuli Mtiririko wa molekuli Msongamano wa Molari Mkusanyiko wa wingi katika mmumunyo Unato wa kinematic Mvutano wa uso Mvutano wa mvuke Upenyezaji wa mvuke, kiwango cha uhamishaji wa mvuke Kiwango cha unyeti wa kipaza sauti Shinikizo la sauti kiwango (SPL) ) Mwangaza Kiwango cha kung'aa Mwangaza Utatuzi wa michoro ya kompyuta Mzunguko na urefu wa wimbi Nguvu ya macho katika diopta na urefu wa kielelezo Nguvu ya macho katika diopta na ukuzaji wa lenzi (×) Chaji ya umeme Msongamano wa chaji ya mstari Msongamano wa chaji ya uso Msongamano wa chaji ya ujazo wa sasa wa umeme Msongamano wa sasa wa mstari wa uso wa sasa msongamano Sehemu ya umeme ya mvutano Uwezo wa umemetuamo na voltage Upinzani wa umeme Maalum upinzani wa umeme Upitishaji wa umeme Upitishaji wa umeme Uwezo wa umeme Uingizaji Kipimo cha waya za Kimarekani Viwango katika dBm (dBm au dBmW), dBV (dBV), wati na vitengo vingine Nguvu ya sumaku. shamba la sumaku Mzunguko wa sumaku Uingizaji wa sumaku Kiwango cha kufyonzwa cha mionzi ya ionizing Mionzi. Kuoza kwa mionzi Mionzi. Kiwango cha mfiduo Mionzi. Dozi iliyonyonywa Viambishi awali vya decimal Mawasiliano ya data Uchapaji na usindikaji wa picha Vipimo vya ujazo wa mbao Hesabu molekuli ya molar Jedwali la mara kwa mara vipengele vya kemikali D. I. Mendeleev
Sehemu za umeme hugunduliwa kwa kutumia mfumo wa viungo nyeti vya umeme kwenye ngozi. Kila bakuli ina bomba iliyojazwa na dutu ya rojorojo ambayo inagusana nayo mazingira ya nje kupitia pores kwenye ngozi ya mnyama. Mwisho wa ndani wa bomba huishia kwenye basement, ambapo seli ziko ambazo hubeba ishara za umeme mfumo wa neva samaki. Hadi sasa, wanasayansi wameshindwa kueleza jinsi ishara dhaifu ya umeme husafiri kupitia bomba kutoka nje hadi kwenye basement.
Hata hivyo, sasa wanafizikia na biofizikia kutoka Chuo Kikuu cha California, Santa Cruz, pamoja na wenzake wengine, wamehitimisha kuwa jelly ni conductor nzuri ya kipekee ya protoni, ambayo pia inaelezea uhamisho wa ishara za umeme. Timu ilijaribu kujaribu sampuli za papa na figili. Wanasayansi kutoka Rosol waliweka kati ya elektroni mbili za paladiamu zenye uwezo wa kunyonya na kutoa moshi idadi kubwa protoni. Voltage inayotumiwa kwa electrodes husababisha protoni kutoka kwa electrode nzuri kuingia kwenye jelly na kuelekea kwenye electrode hasi.
Thamani ya awali
Thamani iliyogeuzwa
siemens kwa mita picosiemens kwa mita mo kwa mita mo kwa sentimita abmo kwa mita abmo kwa kila sentimita statmo kwa mita statmo kwa sentimita siemens kwa sentimita millisiemens kwa kila mita millisiemens kwa kila sentimita microsiemens kwa mita microsiemens kwa kila sentimita ya conductivity ya kawaida ya umeme ya conductivity ya kawaida ya umeme , mgawo. kuhesabu upya 700 ppm, mgawo. kuhesabu upya 500 ppm, mgawo. hesabu upya 640 TDS, ppm, mgawo. hesabu upya 640 TDS, ppm, mgawo. hesabu upya 550 TDS, ppm, mgawo. hesabu upya 500 TDS, ppm, mgawo. hesabu upya 700
Protoni ya sasa ni rahisi kupima kwa sababu ni sawa na mkondo wa umeme unaopita kupitia voltage iliyotumika. Ingawa vipimo vimeonyesha kuwa jeli ni kondakta mzuri wa protoni, haitoi thamani halisi conductivity. Protoni lazima zishinde upinzani wa mawasiliano wakati zinaingia na kuondoka elektroni za palladium, na vipimo vya conductivity vinawaathiri. Hii ilipitishwa na ukweli kwamba kipimo pia kilifanyika kwenye electrodes mbili za dhahabu zilizowekwa kwenye jelly kati ya electrodes ya palladium.
Kupima voltage kati ya electrodes ya dhahabu na sasa kati ya electrodes ya palladium ilituruhusu kuhesabu thamani halisi ya conductivity. Wanasayansi wana hakika kwamba conductivity ya juu ya protoni ya nyenzo hii ya kibiolojia ni kutokana na kuwepo kwa molekuli ya mnyororo inayoitwa keratan sulfate. Ni asidi, ambayo ina maana kila molekuli ya sulfate ya keratin inaweza kutoa protoni ili kuongeza conductivity. Protoni hizi zinaweza kusafiri pamoja na minyororo ya molekuli za maji ambazo huunda karibu na salfati ya keratan.
Zaidi kuhusu conductivity ya umeme
Utangulizi na Ufafanuzi
Uendeshaji maalum wa umeme (au conductivity ya umeme) ni kipimo cha uwezo wa dutu kuendesha mkondo wa umeme au kuhamisha chaji za umeme ndani yake. Hii ni uwiano wa wiani wa sasa kwa nguvu ya shamba la umeme. Ikiwa tunazingatia mchemraba wa nyenzo za conductive na upande wa mita 1, basi conductivity itakuwa sawa na conductivity ya umeme iliyopimwa kati ya pande mbili za kinyume cha mchemraba huu.
Wataalamu huona ugunduzi huu wa kusisimua na kusisimua sana. Takwimu zilizopatikana zinapaswa kuhamasisha utafiti zaidi katika kazi za unyeti wa umeme sio tu ya ampulla ya Lorenzini, bali pia ya viungo mbalimbali kwa ujumla. Data kama hiyo kawaida haipatikani. Sio tu ugunduzi huu unapaswa kusababisha maendeleo ya aina mpya za sensorer za aina tofauti.
Dutu zilizo na joto sawa huonekana kwa joto tofauti. Ikiwa tunagusa mbao na chuma kwa joto sawa, chuma kitaonekana baridi kwa sababu inafanya joto letu liwe na joto zaidi kwa sababu uso wetu unawaka kwa mikono yetu.
Conductivity maalum inahusiana na conductivity kwa formula ifuatayo:
G = σ(A/l)
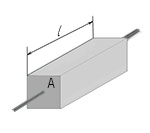
Wapi G- conductivity ya umeme, σ - conductivity maalum ya umeme; A- sehemu ya msalaba wa conductor perpendicular kwa mwelekeo mkondo wa umeme Na l- urefu wa kondakta. Fomula hii inaweza kutumika na kondakta yoyote ya umbo la silinda au prism. Kumbuka kwamba formula hii pia inaweza kutumika kwa parallelepiped ya mstatili, kwa sababu ni kesi maalum ya prism, ambayo msingi wake ni mstatili. Hebu tukumbuke kwamba conductivity ya umeme ni reciprocal ya resistivity umeme.
Conductivity ya joto ni uwezo wa nyenzo kuwasha joto. Kwa kweli, ni kiwango ambacho joto huenea kutoka sehemu moja ya joto ya kitambaa hadi nyingine, baridi zaidi. Conductivity ya joto ya kila dutu imedhamiriwa na mgawo wa conductivity ya mafuta. Kulingana na thamani ya mgawo wa conductivity ya mafuta, tunatofautisha kati ya conductivity nzuri na mbaya ya mafuta.
Metali zote zina conductivity bora ya mafuta. Uondoaji bora wa joto husababisha metali safi kuliko metali zilizochafuliwa au aloi. Metal, ambayo ni conductor bora ya umeme, pia ni conductor bora ya mafuta. Uhusiano kati ya mgawo wa conductivity ya mafuta na mgawo wa conductivity unaonyeshwa katika sheria ya Lorentz-Lorentz. Conductivity ya mafuta na umeme ya metali inapatanishwa na elektroni za bure. Conductivity nzuri ya mafuta ya metali hutumiwa katika teknolojia, radiators za chuma, kuta za boiler ya mvuke, miili ya baridi, nk. yabisi nyingine ni kondakta duni wa mafuta, isipokuwa yabisi.
Inaweza kuwa vigumu kwa watu walio mbali na fizikia na teknolojia kuelewa tofauti kati ya conductivity ya kondakta na conductivity maalum ya dutu. Wakati huo huo, bila shaka, hizi ni tofauti kiasi cha kimwili. Conductivity ni mali ya kondakta fulani au kifaa (kwa mfano, kupinga au umwagaji wa galvanic), wakati conductivity ni mali ya asili ya nyenzo ambayo kondakta au kifaa hiki kinafanywa. Kwa mfano, conductivity ya shaba daima ni sawa, bila kujali jinsi sura na ukubwa wa kitu cha shaba hubadilika. Wakati huo huo, conductivity waya wa shaba inategemea urefu wake, kipenyo, wingi, sura na mambo mengine. Kwa kweli, vitu sawa vilivyotengenezwa kutoka kwa nyenzo zilizo na ubora wa juu vina conductivity ya juu (ingawa sio kila wakati).
Uzoefu wa vitendo: kondakta duni sana wa joto ni gesi na vinywaji, haswa maji. Kwa kupokanzwa maji juu ya bomba, tunaweza kuchemsha huku tukiacha baridi ya chini. Gesi zina mgawo wa chini wa conductivity ya mafuta. Kwa hivyo, pia vitu vyenye vinyweleo vilivyo na hewa ndani ni kondakta duni wa mafuta. Conductivity ya vitu vile inategemea unyevu, hivyo conductivity ya mafuta ya vitu vyenye unyevu ni kubwa zaidi. Dutu ambazo ni conductors duni za joto hutumiwa kwa insulation ya mafuta.

Katika Mfumo wa Kimataifa wa Vitengo (SI), kitengo cha conductivity ya umeme ni Siemens kwa mita (S/m). Sehemu ya conductivity iliyojumuishwa ndani yake imepewa jina la mwanasayansi wa Ujerumani, mvumbuzi, na mjasiriamali Werner von Siemens (1816-1892). Kampuni ya Siemens AG (Siemens) iliyoanzishwa naye mwaka wa 1847 ni mojawapo ya wengi zaidi makampuni makubwa, kuzalisha umeme, umeme, nishati, usafiri na vifaa vya matibabu.
Insulator bora ya mafuta ni utupu. Wanyama wenye damu joto hupasha joto mwili wao ili kuhami mwili wao ili kudumisha halijoto yake kwa nishati kidogo. Wanyama wenye damu baridi, kwa upande mwingine, huponya miili yao kutoka kwa vyanzo vya nje. Insulation ya joto inaweza kuwaingilia. Bata au cetacean kutumia yao mafuta ya subcutaneous kwa insulation ya mafuta.
Vifaa vya Smart kwa karne mpya. Denominator ya kawaida ya Tuzo hii ya Nobel ni kazi ya wanasayansi watatu inayoongoza kwa ugunduzi na maendeleo ya darasa jipya la vitu - kufanya polima. Kuendesha polima huchanganya tabia ya umeme ya kawaida ya semiconductors na mali ya nyenzo ambayo hufanya iwe rahisi kusindika. Wanaweza kubadilisha muundo wao, na kwa hiyo, kulingana na majibu mazingira- yao mali za kimwili. Ndio maana wanaitwa vifaa vya smart. Sifa ya "smart" imezidishwa, lakini tabia ya vifaa vya kusambaza umeme hufanya kuwa muhimu.

Aina mbalimbali za upitishaji umeme ni pana sana: kutoka kwa vifaa vyenye upinzani wa juu kama vile glasi (ambayo, kwa njia, huendesha umeme vizuri ikiwa inapokanzwa nyekundu) au polymethyl methacrylate (plexiglass) hadi conductors nzuri sana kama vile fedha, shaba au dhahabu. Conductivity ya umeme imedhamiriwa na idadi ya malipo (elektroni na ions), kasi ambayo wao huhamia, na kiasi cha nishati wanaweza kubeba. Ufumbuzi wa maji ya vitu mbalimbali, ambayo hutumiwa, kwa mfano, katika bafu ya mchoro, ina maadili ya wastani ya conductivity. Mfano mwingine wa elektroliti zilizo na maadili ya wastani ya conductivity ni mazingira ya ndani ya mwili (damu, plasma, limfu na maji mengine).
Polima hujulikana kama vihami. Wana mema mali ya mitambo na ni rahisi kusindika. Wao hutumiwa kama kuhami makondakta wa umeme, vihami joto au tabaka za kunyonya sauti. Pia zina faida ya kuwa na msongamano mdogo na kwa hivyo zinazidi kutumika katika tasnia ambapo uzani wa chini wa nyenzo unahitajika, kama vile angani au vifungashio. Kwa maombi mengi, mali ya kazi ya polima inaweza kuboreshwa kwa kuzalisha composites, yaani, polima zenye fillers mbalimbali.
Uendeshaji wa metali, semiconductors na dielectrics hujadiliwa kwa undani katika makala zifuatazo za tovuti ya Physical Quantity Converter:, na conductivity ya Umeme. Katika makala hii tutajadili kwa undani zaidi conductivity maalum ya electrolytes, pamoja na mbinu na vifaa rahisi vya kupima.
Conductivity maalum ya umeme ya electrolytes na kipimo chake

Kwa mfano, tabaka za photosensitive zinafanywa kwa xerographs na printers laser, detectors piezoelectric na pyroelectric au photocopiers. Katika composites zenye kaboni nyeusi au grafiti ya unga, conductivity ya umeme iliongezeka kwa kiasi kikubwa. Nyenzo hizo zinafaa, kwa mfano, kwa ajili ya uzalishaji wa makopo ya mafuta nyepesi - composite ya conductive hutoa malipo ya umeme, kwa hiyo hakuna hatari ya kuwaka kwa mvuke tete.
Mbali na composites conductive, pia kuna polima conjugated ambayo inaweza kuonyesha conductivity yao ya juu ya umeme. Hii inaruhusu mzunguko wa mara kwa mara wa bondi moja na mbili ndani muundo wa molekuli. Mbali na mfumo wa dhamana hizi, sharti ni uwepo wa watoa huduma wa malipo ya simu ambao hupatanisha usafiri wa mnyororo uliounganishwa.
Conductivity maalum ya ufumbuzi wa maji ambayo sasa ya umeme hutokea kutokana na harakati ya ioni za kushtakiwa imedhamiriwa na idadi ya wabebaji wa malipo (mkusanyiko wa dutu kwenye suluhisho), kasi ya harakati zao (uhamaji wa ioni). inategemea joto) na malipo wanayobeba (imedhamiriwa na valency ya ions). Kwa hiyo, katika ufumbuzi mwingi wa maji, ongezeko la mkusanyiko husababisha ongezeko la idadi ya ions na, kwa hiyo, kwa ongezeko la conductivity. Hata hivyo, baada ya kufikia kiwango cha juu, conductivity maalum ya suluhisho inaweza kuanza kupungua kwa ongezeko zaidi la mkusanyiko wa suluhisho. Kwa hiyo, ufumbuzi wenye viwango viwili tofauti vya chumvi sawa unaweza kuwa na conductivity sawa.
Kimuundo, polima rahisi zaidi iliyounganishwa ni polyacetylene. Ugunduzi wa kimsingi wa wataalam hawa ulikuwa kugundua kwamba wakati filamu nyembamba ya polyacetylene inapowekwa na mvuke wa iodini, upitishaji wa umeme wa filamu huongezeka kwa karibu mara milioni. Elektroni hutolewa kutoka kwa mnyororo wa polima. Baada ya uhamisho wa elektroni kutoka kwa mlolongo wa polyacetylene hadi molekuli ya iodini, ambayo ni chaji hasi, molekuli ya polyacetylene hubeba malipo mazuri. Tofauti kubwa kati ya semiconductors isokaboni na hai ni kwamba tunaweza kuathiri kwa kiasi kikubwa sifa za umeme za nyenzo katika kufuatilia viwango vya dopant, kwa isokaboni tunahitaji mkusanyiko wa juu kwa polima.
Joto pia huathiri conductivity kwa sababu joto linapoongezeka, ioni huenda kwa kasi, na kusababisha kuongezeka kwa conductivity. Maji safi- kondakta duni wa umeme. Maji ya kawaida ya distilled, ambayo yana katika hali ya usawa kaboni dioksidi kutoka kwa hewa na jumla ya madini chini ya 10 mg / l, ina conductivity maalum ya umeme ya karibu 20 mS / cm. Conductivity maalum ya ufumbuzi mbalimbali hutolewa katika meza hapa chini.
Kwa uhamisho wa malipo ya umeme, kufurika kwa flygbolag kati ya nyaya ni sababu ya kuamua. Usafiri huu hauna ufanisi zaidi kuliko usafirishaji wa malipo katika metali kwa sababu unategemea sana mpangilio wa macromolecules. Uthibitisho ni kwamba filamu zinazoelekezwa kimitambo zinaonyesha upitishaji wa juu wa umeme katika mwelekeo wa urefu kuliko sampuli za asili.
Kazi ya washindi hao watatu inasalia kuwa kilele cha utafiti ulioanza katika miaka ya 1950. Watafiti wengine tayari wameanza kujifunza uhamisho wa elektroni katika vitu vya chini vya Masi na malezi ya kufanya chumvi. Katika miaka ya 1960, Hideo Akamatu na Hiro Inokuchi waliandika monograph Organic Semiconductor, ambayo mifumo halisi ilionyesha kuwa molekuli ndogo zinaweza kuunda conductors na hata superconductors. Mamia ya vifaa vya kikaboni na kuongezeka kwa conductivity ya umeme yameunganishwa katika kutafuta vitu vinavyofaa, lakini hadi sasa haijawezekana kuandaa polima inayofaa.


Kuamua conductivity maalum ya suluhisho, mita ya upinzani (ohmmeter) au conductivity hutumiwa. Hizi ni karibu vifaa vinavyofanana, vinatofautiana tu kwa kiwango. Zote mbili hupima kushuka kwa voltage kwenye sehemu ya saketi ambayo mkondo wa umeme hutiririka kutoka kwa betri ya kifaa. Thamani ya upitishaji kipimo hubadilishwa kwa mikono au kiotomatiki kuwa upitishaji maalum. Hii inafanywa kwa kuzingatia sifa za kimwili kifaa cha kupima au sensor. Sensorer za conductivity ni rahisi: ni jozi (au jozi mbili) za electrodes zilizoingizwa kwenye electrolyte. Sensorer za kupima conductivity zina sifa ya sensor conductivity mara kwa mara, ambayo katika kesi rahisi hufafanuliwa kama uwiano wa umbali kati ya electrodes D kwa eneo (electrode) perpendicular kwa mtiririko wa sasa A
Aniline nyeusi imejulikana tangu karne nyingi. Kutokana na ugumu wa awali, tahadhari ilianza kulipwa kwa polima rahisi zaidi ya mfano - polyacetylene. Ina conformations mbili, trans na cis fomu. Mchanganyiko hutoa mchanganyiko wao. Kutoka kwa mtazamo wa conductivity ya umeme, tu mabadiliko yaliyopatikana na Hideki Shirakawa katika fomu yake safi ni ya kuvutia. filamu ya polima fedha Ilimsaidia kwa bahati mbaya - alitumia kichocheo aina mbalimbali kwa upolimishaji kuliko kawaida, pamoja na mkusanyiko wa elfu.
Kwa upande mwingine wa dunia, MacDiarmid na mwenzake Heger wakati huo walikuwa wakiangalia sifa za polima isokaboni iliyotengenezwa kwa atomi za sulfuri na nitrojeni, ambayo waliifanya kuwa filamu inayofanana na filamu ya chuma. Sifa za polima hii ziliripotiwa na MacDiarmid katika mkutano wa kisayansi huko Tokyo, ambapo alikutana na Shirakawa. Walikubali kuanza kufanya kazi pamoja katika Chuo Kikuu cha Pennsylvania. Trans-polyacetylene ilipandwa na iodini na conductivity yake ya umeme ilichunguzwa.
Njia hii inafanya kazi vizuri ikiwa eneo la elektroni ni kubwa zaidi kuliko umbali kati yao, kwani katika kesi hii wengi sasa umeme inapita kati ya electrodes. Mfano: kwa sentimita 1 ya ujazo wa kioevu K = D/A= 1 cm/1 cm² = 1 cm⁻¹. Kumbuka kuwa vitambuzi vya kondakta vilivyo na elektrodi ndogo zilizotenganishwa kwa umbali mkubwa hubainishwa na thamani za kitambuzi za 1.0 cm⁻¹ na zaidi. Wakati huo huo, vitambuzi vilivyo na elektrodi kubwa kiasi ziko karibu na kila kimoja vina mduara wa 0.1 cm⁻¹ au chini. Sensor mara kwa mara kwa kipimo cha conductivity ya umeme vifaa mbalimbali huanzia 0.01 hadi 100 cm⁻¹.
Matokeo yake yalikuwa idadi ya kazi na makampuni ambayo kisha kuboresha michakato ya kemikali na kuongezeka kwa conductivity ya umeme. Ingawa polyacetylene ina uwezo mkubwa wa kupitishia chuma, inakaribia ile ya metali, haifai kwa matumizi pana na ina upinzani duni wa hali ya hewa. Kwa hiyo, maslahi ya watafiti tangu katikati ya miaka ya 80 yamezingatia polima nyingine zilizounganishwa - polypyrrole, polythiophene, polyaniline, polyphenylene, poly.
Polyaniline labda ndiyo polima ya zamani zaidi ya kikaboni iliyoundwa na mwanadamu. Fritsche, ambaye mara baada ya kupata aniline alitafuta kuunda dyes mpya za syntetisk. Lathby alielezea uoksidishaji wa kielektroniki wa anilini, ambao ulibadilisha rangi hadi bluu baada ya kusukumwa kupitia kwa alkali.

Sensor ya kinadharia mara kwa mara: kushoto - K= 0.01 cm⁻¹, kulia - K= 1 cm⁻¹
Ili kupata conductivity kutoka kwa conductivity iliyopimwa, formula ifuatayo hutumiwa:
σ = K ∙ G
σ - conductivity maalum ya suluhisho katika S / cm;
K- sensor mara kwa mara katika cm⁻¹;
G- conductivity ya sensor katika siemens.
Sensor mara kwa mara haihesabiwi kutoka kwa vipimo vyake vya kijiometri, lakini hupimwa kwa maalum kifaa cha kupimia au katika usanidi maalum wa kipimo kwa kutumia suluhisho la conductivity inayojulikana. Thamani hii iliyopimwa imeingizwa kwenye mita ya conductivity, ambayo huhesabu moja kwa moja conductivity kutoka kwa conductivity iliyopimwa au maadili ya upinzani ya suluhisho. Kwa sababu ya ukweli kwamba conductivity inategemea joto la suluhisho, vifaa vya kuipima mara nyingi huwa na sensor ya joto ambayo hupima joto na hutoa fidia ya joto ya moja kwa moja ya vipimo, yaani, kurekebisha matokeo kwa joto la kawaida la 25 ° C. .
Njia rahisi zaidi ya kupima conductivity ni kutumia voltage kwa elektroni mbili za gorofa zilizowekwa kwenye suluhisho na kupima mtiririko wa sasa. Njia hii inaitwa potentiometric. Kwa mujibu wa sheria ya Ohm, conductivity G ni uwiano wa sasa I kwa voltage U:
Walakini, sio kila kitu ni rahisi kama ilivyoelezwa hapo juu - kuna shida nyingi wakati wa kupima conductivity. Ikiwa sasa ya moja kwa moja inatumiwa, ions hukusanya kwenye nyuso za electrodes. Pia, nyuso za electrodes zinaweza kupata uzoefu mmenyuko wa kemikali. Hii inasababisha kuongezeka kwa upinzani wa polarization kwenye nyuso za electrode, ambayo kwa upande husababisha matokeo mabaya. Ikiwa unajaribu kupima upinzani wa, kwa mfano, ufumbuzi wa kloridi ya sodiamu na tester ya kawaida, utaona wazi jinsi usomaji kwenye maonyesho ya kifaa cha digital hubadilika haraka sana katika mwelekeo wa kuongezeka kwa upinzani. Ili kuondokana na ushawishi wa polarization, muundo wa sensor ya electrodes nne hutumiwa mara nyingi.
Polarization pia inaweza kuzuiwa, au angalau kupunguzwa, ikiwa inatumiwa katika kipimo AC badala ya mara kwa mara, na hata kurekebisha mzunguko kulingana na conductivity. Mzunguko wa chini hutumiwa kupima conductivity ya chini, ambapo ushawishi wa polarization ni mdogo. Frequencies ya juu hutumiwa kupima conductivities ya juu. Kawaida, mzunguko hurekebishwa kiatomati wakati wa mchakato wa kipimo, kwa kuzingatia maadili yaliyopatikana ya suluhisho. Mita za kisasa za dijiti za upitishaji wa elektroni mbili kwa kawaida hutumia mawimbi tata ya AC ya sasa na fidia ya halijoto. Wao ni calibrated katika kiwanda, lakini recalibration mara nyingi inahitajika wakati wa operesheni, tangu mara kwa mara ya kupima kiini (sensor) mabadiliko ya muda. Kwa mfano, inaweza kubadilika wakati sensorer inakuwa chafu au wakati elektroni zinapitia mabadiliko ya kimwili na kemikali.
Katika mita ya jadi ya conductivity ya elektroni mbili (hii ndiyo tutakayotumia katika jaribio letu), voltage mbadala hutumiwa kati ya electrodes mbili na sasa inapita kati ya electrodes inapimwa. Njia hii rahisi ina drawback moja - si tu upinzani wa suluhisho hupimwa, lakini pia upinzani unaosababishwa na polarization ya electrodes. Ili kupunguza ushawishi wa polarization, muundo wa sensorer nne-electrode hutumiwa, pamoja na mipako ya electrodes na platinamu nyeusi.
Uzalishaji wa madini kwa ujumla
Vifaa vya kupima conductivity ya umeme hutumiwa mara nyingi kuamua jumla ya madini au maudhui yabisi(eng. jumla ya mango yaliyoyeyushwa, TDS). Ni kipimo cha jumla ya vitu vya kikaboni na isokaboni vilivyomo katika kioevu katika aina mbalimbali: ionized, molekuli (kufutwa), colloidal na katika kusimamishwa (isiyofutwa). Suluhisho ni pamoja na yoyote chumvi isokaboni. Hasa hizi ni kloridi, bicarbonates na sulfates ya kalsiamu, potasiamu, magnesiamu, sodiamu, pamoja na baadhi ya vitu vya kikaboni vilivyoyeyushwa katika maji. Ili kuainishwa kuwa jumla ya madini, vitu lazima viyeyushwe au kwa namna ya chembe ndogo sana ambazo hupitia vichungi vyenye vipenyo vya pore vya chini ya mikromita 2. Dutu ambazo zimesimamishwa mara kwa mara katika suluhisho, lakini haziwezi kupitia chujio kama hicho, huitwa yabisi iliyosimamishwa(eng. jumla ya yabisi iliyosimamishwa, TSS). Jumla ya yabisi iliyosimamishwa kwa kawaida hupimwa ili kubaini ubora wa maji.

Kuna njia mbili za kupima yaliyomo kwenye vitu vikali: uchambuzi wa gravimetric, ambayo ni zaidi njia sahihi, Na kipimo cha conductivity. Njia ya kwanza ni sahihi zaidi, lakini inahitaji muda mwingi na vifaa vya maabara, kwani maji lazima yamevukizwe ili kupata mabaki ya kavu. Hii kawaida hufanywa kwa joto la 180 ° C hali ya maabara. Baada ya uvukizi kamili, mabaki hupimwa kwa mizani ya usahihi.
Njia ya pili sio sahihi kama uchambuzi wa gravimetric. Hata hivyo, ni rahisi sana, imeenea na ndiyo zaidi njia ya haraka, kwani ni conductivity rahisi na kipimo cha joto kinachofanywa kwa sekunde chache na chombo cha kupimia cha gharama nafuu. Njia ya kupima conductivity maalum ya umeme inaweza kutumika kutokana na ukweli kwamba conductivity maalum ya maji moja kwa moja inategemea kiasi cha vitu ionized kufutwa ndani yake. Mbinu hii hasa yanafaa kwa udhibiti wa ubora maji ya kunywa au kukadiria jumla ya idadi ya ioni katika suluhisho.
Conductivity kipimo inategemea joto la suluhisho. Hiyo ni, joto la juu, conductivity ya juu, kwani ioni katika suluhisho husonga kwa kasi zaidi joto linapoongezeka. Ili kupata vipimo vya kujitegemea kwa joto, dhana ya joto ya kawaida (rejea) hutumiwa ambayo matokeo ya kipimo hupunguzwa. Joto la kumbukumbu hukuruhusu kulinganisha matokeo yaliyopatikana joto tofauti. Kwa hivyo, mita ya conductivity inaweza kupima conductivity halisi na kisha kutumia kazi ya kusahihisha ambayo itarekebisha moja kwa moja matokeo kwa joto la kumbukumbu la 20 au 25 ° C. Ikiwa usahihi wa juu sana unahitajika, sampuli inaweza kuwekwa kwenye incubator, basi mita inaweza kuhesabiwa kwa joto sawa ambalo litatumika katika vipimo.
Mita nyingi za kisasa za conductivity zina sensor ya joto iliyojengwa, ambayo hutumiwa kwa marekebisho ya joto na kipimo cha joto. Vyombo vya juu zaidi vina uwezo wa kupima na kuonyesha maadili yaliyopimwa katika vitengo vya conductivity, resistivity, salinity, salinity jumla na mkusanyiko. Hata hivyo, tunaona tena kwamba vifaa hivi vyote vinapima tu conductivity (upinzani) na joto. Idadi yote ya kimwili iliyoonyeshwa kwenye onyesho huhesabiwa na kifaa kwa kuzingatia halijoto iliyopimwa, ambayo hutumiwa kwa fidia ya halijoto kiotomatiki na kuleta viwango vilivyopimwa kwa halijoto ya kawaida.
Majaribio: kupima jumla ya madini na conductivity
Hatimaye, tutafanya majaribio kadhaa ili kupima upenyezaji kwa kutumia mita ya jumla ya madini ya TDS-3 ya bei nafuu (pia inaitwa salinometer, salinometer, au mita ya conductivity). Bei ya kifaa "kisicho na jina" cha TDS-3 kwenye eBay ikijumuisha uwasilishaji wakati wa kuandika ni chini ya US$3.00. Kifaa sawa, lakini kwa jina la mtengenezaji, gharama mara 10 zaidi. Lakini hii ni kwa wale wanaopenda kulipia chapa, ingawa kuna uwezekano mkubwa sana kwamba vifaa vyote viwili vitatengenezwa kwenye kiwanda kimoja. TDS-3 hubeba fidia ya joto na kwa kusudi hili ina vifaa vya sensor ya joto iko karibu na electrodes. Kwa hiyo, inaweza pia kutumika kama thermometer. Ikumbukwe mara nyingine tena kwamba kifaa hakipimi madini yenyewe, lakini upinzani kati ya electrodes mbili za waya na joto la suluhisho. Huhesabu kila kitu kingine kiotomatiki kwa kutumia vipengele vya urekebishaji.

Jumla ya mita ya uwekaji madini inaweza kukusaidia kubainisha yaliyomo yabisi, kwa mfano wakati wa kuangalia ubora wa maji ya kunywa au kubainisha chumvi ya maji katika hifadhi ya maji au bwawa la maji safi. Inaweza pia kutumika kufuatilia ubora wa maji katika mifumo ya uchujaji wa maji na utakaso ili kujua ni wakati gani wa kuchukua nafasi ya chujio au utando. Chombo hiki kimesahihishwa kiwandani kwa 342 ppm (sehemu kwa milioni au mg/L) ya kloridi ya sodiamu, NaCl. Masafa ya kupimia ya kifaa ni 0–9990 ppm au mg/l. PPM - sehemu kwa milioni, kitengo cha kipimo kisicho na kipimo maadili ya jamaa, sawa na 1 10⁻⁶ kutoka msingi. Kwa mfano, mkusanyiko wa wingi wa 5 mg/kg = 5 mg katika 1,000,000 mg = 5 ppm au ppm. Kama vile asilimia ni mia moja, ppm ni milioni moja. Asilimia na ppm zinafanana sana kimaana. Sehemu kwa milioni, kinyume na asilimia, ni muhimu kwa kuonyesha mkusanyiko wa ufumbuzi dhaifu sana.
Kifaa hupima upitishaji wa umeme kati ya elektroni mbili (ambayo ni, usawa wa upinzani), kisha hubadilisha matokeo kuwa conductivity maalum ya umeme (katika fasihi ya Kiingereza, muhtasari wa EC hutumiwa mara nyingi) kwa kutumia formula ya juu ya conductivity, kwa kuzingatia sensor mara kwa mara. K, kisha hufanya uongofu mwingine kwa kuzidisha conductivity inayotokana na sababu ya uongofu ya 500. Matokeo yake ni thamani ya jumla ya chumvi katika sehemu kwa milioni (ppm). Maelezo zaidi kuhusu hili hapa chini.
Jumla ya mita hii ya madini haiwezi kutumika kupima ubora wa maji yenye chumvi nyingi. Mifano ya vitu vyenye chumvi nyingi ni baadhi ya vyakula (supu ya kawaida yenye chumvi ya kawaida ya 10 g/l) na maji ya bahari. Kiwango cha juu cha mkusanyiko wa kloridi ya sodiamu ambacho kifaa hiki kinaweza kupima ni 9990 ppm au takriban 10 g/l. Huu ni mkusanyiko wa kawaida wa chumvi ndani bidhaa za chakula. Kifaa hiki pia hakiwezi kupima chumvi. maji ya bahari, kwa kuwa kawaida ni 35 g/l au 35,000 ppm, ambayo ni ya juu zaidi kuliko kifaa kinaweza kupima. Ukijaribu kupima mkusanyiko wa juu kama huo, chombo kitaonyesha ujumbe wa hitilafu.
Mita ya chumvi ya TDS-3 hupima upitishaji maalum na hutumia kinachojulikana kama "mizani 500" (au "kipimo cha NaCl") kwa kurekebisha na kugeuza kuwa mkusanyiko. Hii ina maana kwamba ili kupata mkusanyiko wa ppm, thamani ya conductivity katika mS/cm inazidishwa na 500. Hiyo ni, kwa mfano, 1.0 mS/cm inazidishwa na 500 ili kupata 500 ppm. Viwanda tofauti hutumia mizani tofauti. Kwa mfano, katika hydroponics mizani tatu hutumiwa: 500, 640 na 700. Tofauti pekee kati yao ni katika matumizi. Kiwango cha 700 kinategemea kupima mkusanyiko wa kloridi ya potasiamu katika suluhisho na ubadilishaji wa conductivity maalum kwa mkusanyiko hufanywa kama ifuatavyo:
1.0 mS/cm x 700 inatoa 700 ppm
Mizani ya 640 hutumia kigezo cha ubadilishaji cha 640 kubadilisha mS hadi ppm:
1.0 mS/cm x 640 inatoa 640 ppm
Katika jaribio letu, kwanza tutapima jumla ya madini ya maji yaliyosafishwa. Mita ya chumvi inaonyesha 0 ppm. Multimeter inaonyesha upinzani wa 1.21 MOhm.

Kwa jaribio, tutatayarisha suluhisho la kloridi ya sodiamu NaCl yenye mkusanyiko wa 1000 ppm na kupima ukolezi kwa kutumia TDS-3. Ili kuandaa 100 ml ya suluhisho, tunahitaji kufuta 100 mg ya kloridi ya sodiamu na kuongeza maji yaliyotengenezwa kwa 100 ml. Pima 100 mg ya kloridi ya sodiamu na kuiweka kwenye silinda ya kupimia, ongeza maji kidogo ya distilled na koroga hadi chumvi itafutwa kabisa. Kisha kuongeza maji kwa alama ya 100 ml na koroga vizuri tena.
Ili kuamua kwa majaribio conductivity, tulitumia electrodes mbili zilizofanywa kwa nyenzo sawa na kwa vipimo sawa na electrodes ya TDS-3. Upinzani uliopimwa ulikuwa 2.5 KOhm.
Kwa kuwa sasa tunajua upinzani na ukolezi wa ppm wa kloridi ya sodiamu, tunaweza takriban kukokotoa uthabiti wa seli ya mita ya chumvi ya TDS-3 kwa kutumia fomula iliyo hapo juu:
K = σ/G= 2 mS/cm x 2.5 kOhm = 5 cm⁻¹
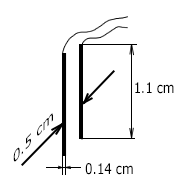
Thamani hii ya sentimeta 5⁻¹ inakaribia thamani isiyobadilika iliyokokotolewa ya seli ya kupimia ya TDS-3 yenye vipimo vya elektrodi vilivyoonyeshwa hapa chini (tazama mchoro).
- D = 0.5 cm - umbali kati ya electrodes;
- W = 0.14 cm - upana wa electrodes
- L = 1.1 cm - urefu wa electrodes
Sensor ya TDS-3 mara kwa mara ni K = D/A= 0.5/0.14x1.1 = 3.25 cm⁻¹. Hii sio tofauti sana na thamani iliyopatikana hapo juu. Hebu tukumbuke kwamba formula hapo juu inaruhusu tu makadirio ya takriban ya mara kwa mara ya sensor.
Je, unaona vigumu kutafsiri vitengo vya kipimo kutoka lugha moja hadi nyingine? Wenzake wako tayari kukusaidia. Chapisha swali katika TCTerms na ndani ya dakika chache utapokea jibu.
Unakumbuka kutoka kwa kozi ya fizikia kwamba upinzani wa umeme wa kondakta yeyote unaweza kuhesabiwa kwa kutumia formula:
ambapo R ni upinzani katika Ohms;
l - urefu wa conductor, cm;
S - eneo la msalaba, cm 2;
r- resistivity, i.e. upinzani wa kondakta urefu wa 1 cm na eneo la sehemu ya 1 cm 2.
Katika kemia ya elektroni, ni kawaida kutumia idadi ya usawa iliyoonyeshwa:
Thamani L inaitwa conductivity ya umeme na inapimwa katika Siemens (Sm) Sm = Ohm -1.
Kiasi À inaitwa conductivity maalum ya umeme. Ni rahisi kuamua kuwa thamani À inapimwa kwa cm×cm -1. Katika Mchoro 3.1. kiini cha conductometric kinachotumiwa kupima conductivity ya umeme kinawasilishwa. Ni chombo 1, bila ya chini, ambayo elektroni mbili za platinamu 2 huingizwa, zimewekwa kwenye suluhisho la jaribio 3.
Thamani ya K imedhamiriwa kwa majaribio. Kwa kufanya hivyo, ni muhimu kupima conductivity ya umeme L ya suluhisho ambayo À inajulikana. Kawaida, suluhisho la kloridi ya potasiamu ya mkusanyiko unaojulikana (0.1; 0.05; 0.01 mol / dm 3) hutumiwa kwa kusudi hili, maadili ambayo yanapatikana kwenye meza.
Kutoka kwa equation (3.5.) inafuata hiyo
Conductivity maalum ni conductivity ya umeme ya suluhisho iliyowekwa kati ya elektroni mbili na eneo la 1 cm2, iko kwa umbali wa 1 cm.
| À HCl KOH HF CH 3 COOH C Kielelezo 3.2 Utegemezi wa conductivity maalum juu ya mkusanyiko | Conductivity maalum ya umeme ya suluhisho inategemea asili ya kutengenezea na solute, mkusanyiko wa suluhisho na joto. Katika Mchoro 3.2. grafu za utegemezi wa À juu ya mkusanyiko wa ufumbuzi wa maji wa baadhi ya elektroliti kwa joto la mara kwa mara huwasilishwa kutoka kwa takwimu, kwanza kabisa, inafuata kwamba kwa viwango sawa vya ufumbuzi, conductivity ya ufumbuzi wa electrolytes kali ni ya juu zaidi. kwa sababu yana |
ioni zaidi zinazobeba umeme. Katika ufumbuzi wa kuondokana na elektroliti zenye nguvu na dhaifu, ongezeko la mkusanyiko husababisha ongezeko la conductivity, ambalo linahusishwa na ongezeko la idadi ya ions. Katika eneo la viwango vya juu, kupungua kwa À huzingatiwa. Kwa electrolytes kali, hii ni kutokana na ongezeko la viscosity ya ufumbuzi na ongezeko la mwingiliano wa umeme kati ya ions. Kwa electrolytes dhaifu, athari hii inahusishwa na kupungua kwa kiwango cha kujitenga na, kwa hiyo, kupungua kwa idadi ya ions.
Kadiri hali ya joto inavyoongezeka, conductivity maalum ya elektroliti huongezeka:
А 2 = А 1 [ 1 + a(T 2 - T 1)] (3.7.)
Katika equation hii, À 1 na À 2 ni conductivity maalum katika joto T 1 na T 2, na a ni mgawo wa joto wa conductivity. Kwa mfano, kwa chumvi a »0.02. Hii ina maana kwamba ongezeko la digrii moja katika joto husababisha ongezeko la conductivity ya takriban 2%. Hii ni kwa sababu ya ukweli kwamba kwa kuongezeka kwa joto kiwango cha unyevu na mnato wa suluhisho hupungua.
Ikumbukwe kwamba, tofauti na electrolytes, conductivity ya umeme ya metali hupungua kwa joto la kuongezeka.
Molar conductivity umeme
Uendeshaji wa molar l unahusiana na upitishaji maalum kwa formula:
l = À×1000/s (3.8.)
Katika usemi huu, c ni mkusanyiko wa molar wa suluhisho, mol×dm -3. Conductivity ya molar inaonyeshwa kwa cm × cm 2 × mol -1. Kwa hiyo,
conductivity ya molar ni conductivity ya suluhisho iliyo na mole 1 ya dutu kwa umbali kati ya electrodes ya 1 cm.
Upitishaji wa umeme wa molar wa elektroliti zenye nguvu na dhaifu hupungua kwa mkusanyiko unaoongezeka. Hali ya utegemezi wa l juu ya c kwa electrolytes kali na dhaifu ni tofauti, kwa sababu ushawishi wa mkusanyiko ni kutokana na sababu mbalimbali.
Elektroliti zenye nguvu. Katika viwango vya chini, utegemezi wa conductivity ya molar kwenye mkusanyiko unaonyeshwa na equation ya nguvu ya Kohlrausch:
l = l 0 -bÖс (3.9.)
ambapo b imedhamiriwa mara kwa mara kwa majaribio,
na l 0 - upitishaji wa umeme wa molar katika dilution isiyo na kikomo au kupunguza upitishaji wa molar.
Hivyo,
liml C ® 0 = l 0 (3.10.)
Haiwezekani kuandaa suluhisho ambalo mkusanyiko wake ni sifuri. Thamani ya l 0 kwa elektroliti kali inaweza kuamua kwa picha. Kutoka kwa equation (3.9.) inafuata kwamba grafu ya l = f (Öc) kwa electrolytes kali ni mstari wa moja kwa moja (Mchoro 3.3., mstari wa 1).
Ikiwa unatayarisha mfululizo wa ufumbuzi wa viwango tofauti, kupima conductivity yao L, kuhesabu na njama l = f (Öc), kisha kusambaza mstari wa moja kwa moja unaosababisha kwa kuratibu (c = 0), unaweza kuamua l 0. Ikiwa tunazingatia kwamba elektroliti zenye nguvu, bila kujali mkusanyiko wa suluhisho, zimetenganishwa kabisa, tunafikia hitimisho kwamba idadi ya ions inayoundwa kutoka kwa mole 1 ya dutu daima ni sawa. Hii ina maana kwamba kasi ya harakati ya ions inategemea mkusanyiko wa suluhisho na kuongezeka kwa mkusanyiko, huongezeka kizuizi cha ion. Jambo hili linahusishwa na malezi karibu na kila ioni katika suluhisho anga ya ionic, inayojumuisha zaidi ioni za ishara iliyo kinyume. Wakati mkusanyiko unapoongezeka, mnato wa suluhisho pia huongezeka. Kuna sababu zingine za kupunguza kasi ya harakati ya ion ndani uwanja wa umeme, ambayo hatutakaa juu yake.
Ikiwa utaamua kwa majaribio thamani ya l kwa suluhisho la mkusanyiko fulani na kupata picha l 0, unaweza kuhesabu thamani ya mgawo wa conductivity ya umeme. f :
f= l / l 0 (3.11.)
Mgawo f inaashiria kiwango cha kizuizi cha ions na huwa na umoja wakati suluhisho limepunguzwa.
Elektroliti dhaifu. Conductivity ya molar ya electrolytes dhaifu ni kwa kiasi kikubwa chini ya ufumbuzi wa electrolytes kali (Mchoro 3.3, mstari wa 2). Hii ni kutokana na ukweli kwamba hata katika viwango vya chini kiwango cha kujitenga kwa electrolytes dhaifu ni ndogo. Kuongezeka kwa conductivity ya molar ya electrolytes dhaifu wakati ufumbuzi ni diluted inahusishwa na ongezeko la kiwango cha kujitenga kwa mujibu wa sheria ya dilution Ostwald. S. Arrhenius alipendekeza kwamba upitishaji wa molar wa elektroliti dhaifu unahusiana na kiwango chake cha kujitenga kwa usemi:
a= l / l 0 (3.12.)
Kwa hivyo, kiwango cha kutengana kwa electrolyte dhaifu kinaweza kuhesabiwa ikiwa kiwango cha juu cha conductivity yake ya molar l 0 inajulikana. Walakini, haiwezekani kuamua l 0 kwa picha kwa kuzidisha grafu l = f(Öc), kwa sababu. curve (Mchoro 3.3., mstari wa 2) na mkusanyiko unaopungua unakaribia kuratibu.
Thamani l 0 inaweza kuamua kwa kutumia sheria uhuru wa harakati ya ion ya Kohlrausch:
Conductivity ya umeme ya molar ya electrolyte na dilution isiyo na kipimo ya suluhisho ni sawa na jumla ya uhamaji wa juu wa cations na anions.
l 0 =l 0,+ + l 0,– (3.13.)
Uhamaji wa cation na anion ni sawia na kasi kamili ya harakati ya ions (tazama Jedwali 3.1.).
l 0 + = F×U +; l 0,– = F×U – (3.14.)
Katika fomula hizi, F ni kitengo cha umeme kinachoitwa Faraday, sawa na 96494 Coulombs (C). Katika Jedwali 3.2. Upeo wa uhamaji wa ions fulani hutolewa.
Ikumbukwe kwamba sheria ya uhuru wa harakati ya ion ni halali kwa electrolytes dhaifu na yenye nguvu.
Jedwali 3.2.
Kupunguza uhamaji wa ioni (cm 2 ×Cm×mol -1) kwa 25 0 C
| cation | l 0,+ | Anion | l 0,- |
| H + K + Na + Li + Ag + Ba 2+ Ca 2+ Mg 2+ | 349,8 73,5 50,1 38,7 61,9 127,2 119,0 106,1 | OH - I - Br - Cl - NO 3 - CH 3 COO - SO 4 2- | 76,8 78,4 76,3 71,4 40,9 160,0 |
Maombi ya vipimo vya conductivity
Njia ya utafiti kulingana na kupima conductivity ya umeme inaitwa conductometry. Njia hii hutumiwa sana katika mazoezi ya maabara. Kifaa cha kupima conductivity ya umeme kinaitwa mita ya conductivity. Hasa, njia ya conductometric inafanya uwezekano wa kuamua vipengele vya kujitenga vya electrolytes dhaifu.
Mfano. Uamuzi wa utengano wa mara kwa mara wa asidi asetiki.
a) Ili kupata mara kwa mara ya kiini cha conductometric, tulitayarisha ufumbuzi wa kloridi ya potasiamu na viwango vya molar ya 0.1 na 0.02 mol × dm -3 na kupima conductivity yao Ilibadilika kuwa sawa na L 1 = 0.307 S na L 2 = 0.0645 S, mtawaliwa katika jedwali tunapata maadili ya upitishaji maalum wa suluhisho la kloridi ya potasiamu ya viwango vilivyoonyeshwa:
À 1 = 1.29×10 -1 Sm×cm -1; À 2 = 2.58×10 -2 Sm×cm -1
Kulingana na equation 3.6. Tunahesabu seli mara kwa mara:
K 1 = À 1 / L 1 = 0.42 cm -1
K 2 = À 2 / L 2 = 0.40 cm -1
Thamani ya wastani K = 0.41 cm -1
b) Tulitayarisha suluhisho mbili za asidi ya asetiki na viwango c 1 = 0.02 mol × dm -3 na c 2 = 1 × 10 -3 mol × dm -3. Kwa kutumia conductometer, conductivity yao ya umeme ilipimwa:
L 1 = 5.8 × 10 -4 cm; L 2 = 1.3 × 10 -4 Tazama.
c) Kuhesabu conductivity maalum:
А 1 = L 1 ×K = 5.8×10 -4 ×0.41 = 2.378×10 -4 Cm×cm -1
À 2 = L 2 ×K = 1.2×10 -4 ×0.41 = 0.492×10 -4 Sm×cm -1
d) Kutumia formula (3.8.) tunapata conductivity ya molar umeme l 1 = 11.89 Sm × cm 2 × mol -1; l 2 = 49.2 cm×cm 2 × mol -1
e) Tunapata kwa kutumia jedwali 3.2. thamani ya conductivity ya juu ya molar ya asidi asetiki: l 0 = 349.8 +40.9 = 390.7 Sm×cm 2 × mol -1.
e) Hatimaye, kwa kila suluhisho tunahesabu kiwango cha kutengana (equation 3.12.) na mara kwa mara ya kutenganisha.
a 1 = 3.04×10 -2; a 2 = 1.26×10 -1
K 1 = 1.91×10 -5; K 2 = 1.82×10 -5
Thamani ya wastani K = 1.86×10 -5
